
Poradnik
Spis treści:
1. Klasyfikacja czystości powietrza w pomieszczeniach czystych
Klasy czystości powietrza według US Federal Standard 209E
W gałęziach przemysłu takich jak przemysł elektroniczny, farmaceutyczny, spożywczy,
chemiczny, włókienniczy pomieszczenia klasyfikuje się najczęściej ze względu na ilość
zanieczyszczeń cząstkami stałymi występujących w powietrzu wewnętrznym. Daną klasę powietrza
określa się przez podanie maksymalnej liczby cząstek o określonej średnicy i większej w jednostce
objętości powietrza. W Polsce do 2002 roku nie było wymagań dotyczących pomieszczeń czystych,
jednak starano się utrzymać pewien standard bazując na normach i standardach zachodnioeuropejskich.
Najczęściej stosowaną normą była amerykańska norma Federal Standard 209.
Ostatnie, piąte wydanie z 11 września 2002 zostało oznaczone literą E.
Pełny tytuł tej normy brzmi: "Klasy zanieczyszczenia cząsteczkami zawieszonymi w powietrzu w czystych
pomieszczeniach i czystych strefach".
Norma ta wprowadza podział na klasy znormalizowane i dopuszcza
alternatywne klasy czystości powietrza dla czystych pomieszczeń i czystych stref w oparciu o określone
stężenia cząstek zwieszonych w powietrzu. Opisuje ona metody weryfikacji czystości powietrza i wymagania
ustanowienia planu monitorowania czystości powietrza. Podaje ona również metodę określania i opisywania
stężeń bardzo drobnych cząstek. Norma nie określa właściwości fizycznych i chemicznych cząsteczek
zawieszonych w powietrzu. Nie podaje także zależności pomiędzy stężeniem cząstek zawieszonych w powietrzu
a stężeniem mikroorganizmów unoszących się w powietrzu. Granice stężeń w poszczególnych klasach wg US Federal
Standard 209E przytoczono w tabeli nr 1.
Tabela 1. Podział na klasy czystości wg US Federal Standard 209E [1]
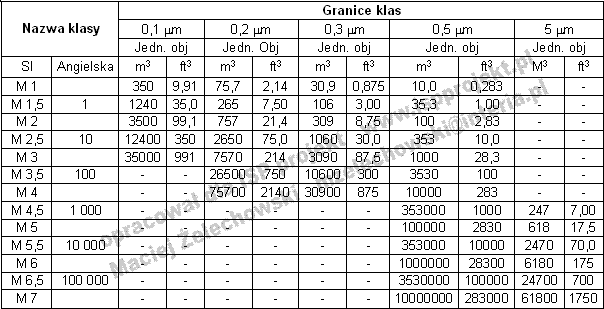
Liczba cząstek/m3=10M/(0.5/d)2.2 (1)
gdzie:
M - jest to liczbowe oznaczenie klasy oparte na jednostkach SI,
d - jest wymiarem cząstki w mikrometrach.
Klasy czystości według PN-EN ISO 14644-1:2002
W 2002 Polski Komitet Normalizacyjny wprowadził normy sankcjonujące standardy europejskie m.in.: PN-EN ISO 14644-1:2002 Pomieszczenia czyste i związane z nimi środowiska kontrolowane - Część 1: Klasyfikacja i czystość powietrza. Norma ta wprowadza 9 klas czystości powietrza. Określa ona, jakie mogą być maksymalne stężenia poszczególnych rozmiarów cząstek z przedziału od 0,1-5,0 mm. Klasyfikacja czystości powietrza według PN-EN ISO 14644-1:2002 została przedstawiona w tabeli nr 2.Tabela 2. Podział na klasy czystości wg PN-EN ISO 14644-1:2002 [2]
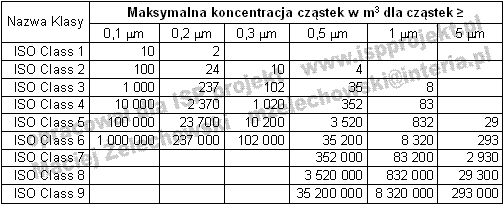
![]() (2)
(2)
gdzie:
Cn - maksymalne stężenie cząstek zawieszonym w m3 powietrza o rozmiarach równych i większych niż D,
D - rozmiar rozpatrywanych cząstek w mikrometrach,
N - nazwa klasy czystości według ISO nie przekraczając klasy 9. Można wyznaczać klasy pośrednie z dokładnością do 0,1.
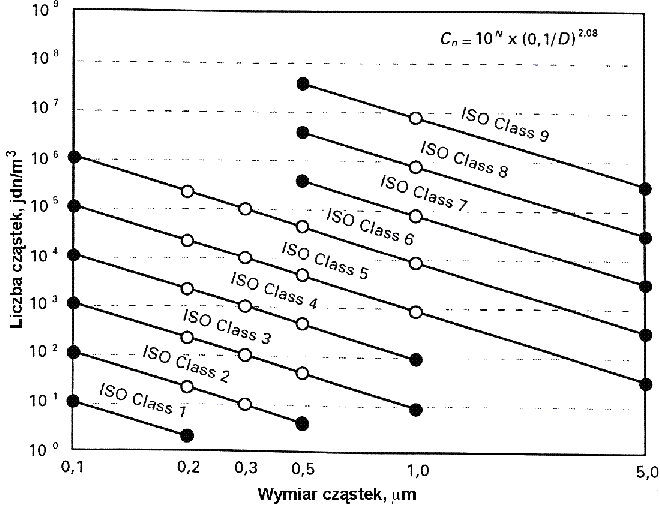
Rys. 1. Podział na klasy czystości wg PN-EN ISO 14644-1:2002 [2]
Klasy czystości według rozporządzenia MZ z dnia 3 grudnia 2002 roku
Rozporządzenie Ministra Zdrowia z dnia 3 grudnia 2002 roku zawarte w Dzienniku Ustaw z Dzienniku Ustaw z dnia 21 grudnia 2002 roku wprowadza przepisy w sprawie wymagań Dobrej Praktyki Wytwarzania. Rozporządzenie to określa wymagania Dobrej Praktyki Wytwarzania, których spełnienie jest warunkiem uzyskania zezwolenia na wytwarzanie środków farmaceutycznych. Określa, jaka klasa czystości powietrza musi być utrzymywana w pomieszczeniu lub określonej strefie przy produkcji leków.Rozporządzenie szczegółowo omawia jak powinna przebiegać produkcja leków sterylnych i niesterylnych. Przy produkcji tych leków powinny być zachowane szczególne wymagania, mające na celu zminimalizowanie ryzyka zanieczyszczenia mikrobiologicznego oraz mechanicznego. Rozporządzenie reguluje szczegółowo metodę oznaczania czystości mikrobiologicznej i zanieczyszczeń cząstkami mechanicznymi i nakazuje stosować normy CEN/ISO. Według rozporządzenia produkcja powinna spełniać następujące wymagania:
- produkcja produktów sterylnych powinna odbywać się w pomieszczeniach czystych, do których kadra pracownicza i niezbędny sprzęt wprowadzany jest przez śluzy powietrzne. Pomieszczenia czyste powinny być utrzymane w odpowiednich standardach czystości,
- wszystkie czynności począwszy od przygotowania składników po napełnianie powinno przebiegać w oddzielnych pomieszczeniach w obrębie obszaru czystego,
- wytwarzanie produktu sterylnego dzieli się na: preparaty, które można sterylizować w opakowaniu bezpośrednim i preparaty produkowane aseptycznie,
- wytwarzanie produktów sterylnych powinno przebiegać w obszarze, w którym utrzymany jest odpowiedni poziom czystości środowiska, w celu minimalizacji możliwości zanieczyszczenia produktu.
- klasa A - jest to klasa, w której wykonywane są czynności największego ryzyka np. napełnianie, zamykane korkami, wykonywanie aseptycznych połączeń, miejsca gdzie produkt ma kontakt ze środowiskiem,
- klasa B - klasa ta stanowi najczęściej rolę strefy oddzielającej klasę A od klasy C,
- klasa C i D - są to pomieszczenia, w których przeprowadza się mniej krytyczne etapy wytwarzania produktów sterylnych np. przygotowanie roztworów.
Tabela 3. Podział na klasy czystości wg rozporządzenia Ministra Zdrowia z dnia 3 grudnia 2002 roku [3]
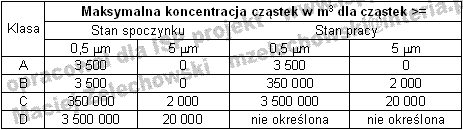
Tabela 4. Przykładowe czynności, które mogą być wykonywane w pomieszczeniach określonej klasy [3]
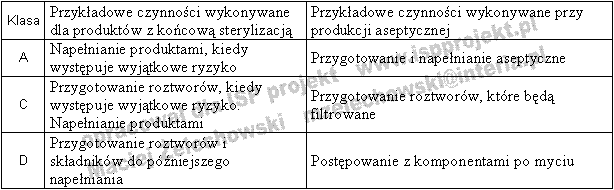
Tabela 5. Zalecane limity zanieczyszczeń mikrobiologicznych w pomieszczeń czystych wg rozporządzenia Ministra Zdrowia z dnia 3 grudnia 2002 roku [3]

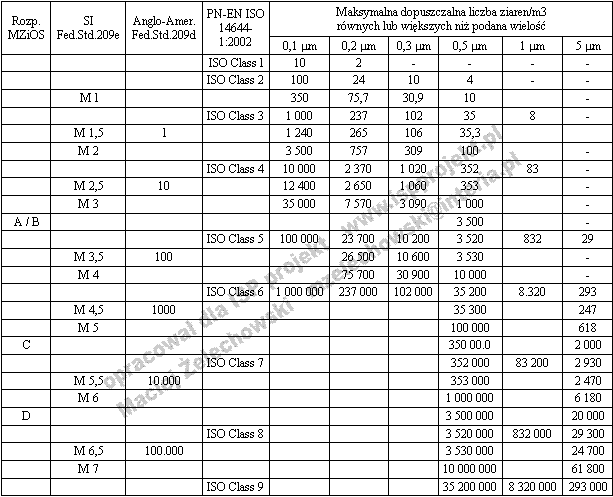
Klasy czystości w przytoczonych normach i w rozporządzeniu nie zawierają dużych rozbieżności. Można stosować nazewnictwo zamiennie z przytoczonych tu norm i zostanie ono odpowiednio zrozumiane. Rozporządzenie określa, że wytyczne dla maksymalnej dozwolonej liczby cząstek "w spoczynku" odpowiadają wartościom obowiązującym w USA (United States Federal Standard 209 E) i normom ISO w następujący sposób: klasy A i B odpowiadają klasie 100, M 3.5, ISO 5; klasa C odpowiada klasie 10.000, M 5.5, ISO 7 i klasa D odpowiada klasie 100.000, M 6.5, ISO 8. Jednak po dokładnym przeliczeniu widać niewielkie różnice w ilości ziaren wg poszczególnych norm. Tabela nr 9 przedstawia zestawienie klas powietrza wg przytoczonych norm.
Nie przytoczono tutaj innych mniej znanych aczkolwiek używanych w Polskich zakładach farmaceutycznych norm zachodnich, czyli:
- VDI 2083 - norma Niemiecka,
- BS 5295 - norma Angielska,
- AFNOR 44101 i 44102 - normy Francuskie.
Tabela 6. Porównanie klasyfikacji pomieszczeń czystych wg rozporządzenia MZ, U.S. Federal Standard 209d,e i PN-EN ISO 14644-1:2002 [3]
Strefy czystości powietrza
Ze względu na brak wymagań urzędowych, firmy farmaceutyczne, na podstawie monitoringu higieny prowadzonego w swoich wytwórniach, ustalały właściwe dla wytwarzania leków, wymagania dla jakości powietrza, powierzchni pomieszczeń, urządzeń, ubrań i poruszania się personelu. Powszechny był podział na trzy strefy. Podział ten stosowany jest do dziś:- strefa czarna - jest to strefa do której zalicza się pomieszczenia nie związane bezpośrednio z produkcją: warsztaty naprawcze, zaplecze techniczne, pomieszczenia socjalne, magazyny surowców oraz tzw. szatnie brudne lub pierwszego stopnia. W nazewnictwie farmaceutycznym strefa ta nazywana jest także jako strefa niekontrolowana,
- strefa szara - jest to strefa, w której prowadzi się produkcję niesterylnych form leków. Strefa szara czasami jest dzielona na strefę szarą czystą i szarą kontrolowaną. Przeprowadzanie operacji technologicznych, w których produkt może być narażony na kontakt ze środowiskiem np. pakowanie pierwotne, wytwarzanie produktów luzem powinno przebiegać w warunkach właściwych dla strefy szarej czystej. Wymagania czystości powietrza i ubrań personelu są zbliżone do klasy D w strefie białej. W strefie szarej kontrolowanej przeprowadza się takie procesy jak pakowanie wtóre bądź transport wewnętrzny. W pomieszczeniach strefy szarej wymagany jest monitoring mikrobiologiczny. W tej strefie dopuszcza się produkcję niektórych tabletek, drażetek, maści i syropów.
- strefa biała - jest to strefa, w której przeprowadza się czynności produkcyjne związane z wytwarzaniem leków jałowych. W strefie białej wyróżnia się cztery klasy czystości powietrza A, B, C i D.
- preparaty, w przypadku których sterylizacja może przebiegać w opakowaniu bezpośrednim,
- preparaty produkowane aseptycznie.
Bibliografia:
[1] Federal Standard, Airbone particulate cleanliness classes in cleanrooms and zones. Fed-Std-209e, 1992.
[2] ISO 14644-1 "Cleanrooms and associated controlled environments - Part 1: Classification of air clean liness"
[3] Dziennik Ustaw nr 224 artykuł 1882 z 2002 roku.
[4] Praca zbiorowa. "Poradnik GMP. Dobra praktyka wytwarzania środków farmaceutycznych i materiałów medycznych".
Projekty instalacji sanitarnych